Esperienze di laboratorio
- Elettrolisi
- Preparazione di alcuni composti chimici
- Preparazione di un indicatore di PH
- Saggio alla fiamma
ELETTROLISI
SCISSIONE DEI COMPONENTI DI UN COMPOSTO CHIMICO ATTRAVERSO L’ ELETTRICITÀ
1)
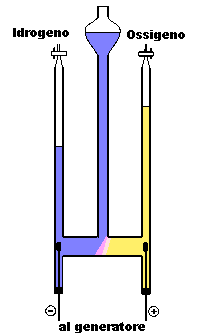
Elettrolisi dell’acqua
Materiali
-
apparecchio di Hoffmann
-
soluzione acquosa di acido solforico
-
generatore di energia elettrica
-
due elettrodi di grafite
Procedimento
Inserire le burette nel loro alloggiamento, aprire i rubinetti e versare la soluzione preparata nell'ampolla centrale fino al raggiungimento della tacca zero nelle due burette laterali.
Chiudere i rubinetti, collegare gli elettrodi all'alimentatore, accendere l'alimentatore (20-30 volt);
Si osserverà immediatamente lo sviluppo di bollicine di gas in prossimità degli elettrodi;
Lasciar funzionare il voltametro per qualche tempo (5-10 minuti) sino a far scendere di qualche cm il livello del liquidi nelle due canne;
Le reazioni che si svolgono ai due elettrodi possono così essere riassunte:
![]() sono
2H2O O2 + 2H2
sono
2H2O O2 + 2H2
Dopo aver spento l'alimentatore, leggiamo i volumi dei gas raccolti nelle due canne; se la tenuta dei rubinetti è perfetta il gas raccolto in corrispondenza del polo negativo sarà il doppio di quello raccolto al polo positivo.
Conclusioni
L’acqua, grazie all’azione della corrente elettrica viene scissa in idrogeno e ossigeno secondo un rapporto ben preciso (2:1) .
2) elettrolisi di una soluzione di acetato di PIOMBO
Materiali
-
Becker
-
Generatore di corrente elettrica
-
Due lamine di piombo come elettrodi
-
Soluzione acquosa di acetato di piombo
Procedimento
Abbiamo immerso gli elettrodi , dopo averli collegati con il generatore di corrente, nella soluzione di acetato di piombo e abbiamo osservato.
Conclusioni
Dopo alcuni minuti abbiamo notato che nell’elettrodo negativo si erano depositati dei cristalli di piombo. Allo stesso modo si possono ottenere anche altri metalli allo stato puro.
3) ELETTROLISI DI SOLUZIONE ACQUOSA DI IODURO DI POTASSIO
Materiali
-
Scatola di Petri
-
Pila da 4,5 volt
-
elettrodi di ottone
-
Soluzione acquosa di ioduro di potassio
-
Fenoftaleina ( indicatore )
Procedimento
Collegare gli elettrodi al generatore, in questo caso rappresentato dalla pila e immergere gli elettrodi nella soluzione contenente lo ioduro di potassio e un indicatore (fenolftaleina).
Conclusioni
Dopo qualche minuto in prossimità degli elettrodi la soluzione assume un colore ben preciso.
All’anodo la soluzione assumerà una colorazione giallo-bruna dovuta allo iodio, mentre al catodo la soluzione assume una colorazione fucsia. Tale colorazione è dovuta alla formazione dei gruppi OH- .